Los biofilms representan uno de los mayores retos en la lucha contra las infecciones asociadas a la atención sanitaria (IAAS), ya que hacen que los patógenos sean mucho más tolerantes a los métodos convencionales de limpieza y desinfección. Los productos de dióxido de cloro de Tristel han sido específicamente evaluados por su eficacia frente a biofilms tanto húmedos como secos.
El reto del biofilm en el entorno sanitario
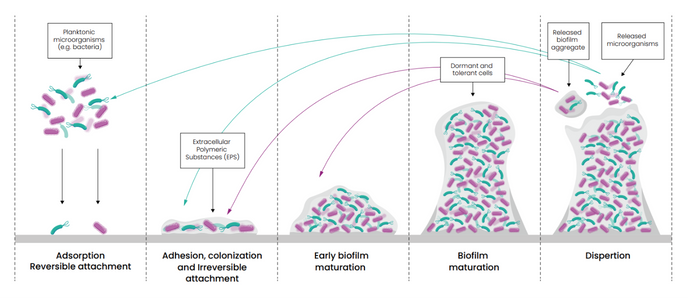
Los biofilms son comunidades microbianas estructuradas, envueltas en una matriz producida por los propios microorganismos, que se adhieren con facilidad a las superficies del entorno sanitario. Una vez formados, su erradicación resulta especialmente compleja. No se trata únicamente de un problema de limpieza, sino de un problema de seguridad del paciente.
Los biofilms actúan como reservorio de microorganismos multirresistentes (MDROs), protegiéndolos frente a los antimicrobianos y favoreciendo además la transferencia horizontal de genes, lo que acelera la propagación de la resistencia.
Las bacterias que viven en forma de biofilm pueden mostrar una resistencia a los antibióticos entre 10 y 1.000 veces superior en comparación con las bacterias en estado planctónico.
Diversos estudios indican que hasta el 65 % de todas las infecciones microbianas y el 80 % de las infecciones crónicas están relacionadas con biofilms. Su presencia puede dar lugar a infecciones persistentes, menor respuesta a los tratamientos y un mayor riesgo de contaminación cruzada. Además, los biofilms presentes en instrumental médico, superficies ambientales o sistemas como las redes de agua pueden contribuir de forma significativa a las infecciones nosocomiales, suponiendo un riesgo serio para la seguridad del paciente.1,2
¿Son todos los biofilms iguales?
Aunque todos los biofilms comparten la característica de ser comunidades microbianas encapsuladas en una matriz protectora, su composición y comportamiento pueden variar considerablemente. Pueden estar formados por bacterias, levaduras, hongos e incluso virus. Habitualmente incluyen una o varias especies microbianas y pueden persistir sobre una superficie durante muchas horas.
El biofilm húmedo se forma en entornos con humedad, donde los microorganismos proliferan gracias a la presencia de agua y nutrientes disponibles. Estos microorganismos secretan una capa viscosa de sustancias poliméricas extracelulares (EPS), compuesta por polisacáridos, proteínas y lípidos, que los integra en una matriz protectora. Normalmente están asociados a bacterias gramnegativas, como Pseudomonas aeruginosa. En el ámbito sanitario, los biofilms húmedos pueden desarrollarse en los canales internos de dispositivos médicos reutilizables, en circuitos de agua, así como en lavabos, duchas, inodoros y las superficies que los rodean.
El biofilm seco, por su parte, está formado por microorganismos que sobreviven en entornos secos o con muy baja humedad y escasez de nutrientes. Estas condiciones adversas hacen que los microorganismos que lo componen sean especialmente resistentes. A diferencia de los biofilms húmedos, los biofilms secos se encuentran en superficies con mínima presencia de agua, como equipos médicos o superficies ambientales secas. Su detección y eliminación resulta compleja, ya que suelen ser más resistentes a los procesos habituales de limpieza y desinfección.
Dióxido de cloro: actuando frente al biofilm
Existen distintos métodos para evaluar la eficacia de un desinfectante frente a biofilms.
En el caso de los biofilms húmedos, se emplean ensayos como el MBEC (ASTM E2799) y el modelo CDC (ASTM E2871-22), que permiten evaluar la eficacia frente a biofilms de Staphylococcus aureus y Pseudomonas aeruginosa.
Las soluciones de dióxido de cloro de Tristel han sido evaluadas mediante estos métodos frente a biofilms desarrollados durante un periodo de 72 horas. Todas las soluciones ensayadas alcanzaron reducciones ≥4 log en el ensayo MBEC y ≥5 log en el modelo CDC, en tiempos de contacto tan cortos como 30 segundos. Esta actividad rápida y robusta resulta clave en los flujos reales de trabajo en prevención y control de infecciones, donde el tiempo y la eficacia deben ir de la mano.
Para los biofilms secos, la eficacia del dióxido de cloro se evaluó utilizando el modelo CDC (ASTM E2871-22) modificado, incorporando un ciclo de deshidratación y rehidratación de 12 días. Este enfoque está cada vez más reconocido por reproducir de forma más fiel los retos reales de descontaminación asociados a los biofilms. Todas las soluciones de dióxido de cloro evaluadas lograron reducciones ≥5 log en sus respectivos tiempos de contacto.
Implicaciones para la prevención de infecciones
Dado que el dióxido de cloro ha demostrado ser eficaz tanto frente a contaminantes superficiales como frente a biofilms consolidados, su integración en los protocolos rutinarios de prevención y control de infecciones (PCI) puede ayudar a abordar de forma efectiva el reto que suponen los biofilms, reduciendo la brecha entre el cumplimiento normativo y la eficacia en condiciones reales.
Nuestras soluciones de desinfección de alto nivel para dispositivos médicos:
Nuestras soluciones de desinfección esporicida para superficies en el ámbito sanitario:
Reference:
1 Ledwoch, K., Dancer, S.J., Otter, J.A., Kerr, K., Roposte, D., Rushton, L., Weiser, R., Mahenthiralingam, E., Muir, D.D. and Maillard, J.-Y. . (2018). Beware biofilm! Dry biofilms containing bacterial pathogens on multiple healthcare surfaces; a multi-centre study. Journal of Hospital Infection, 100(3), pp.e47–e56. doi:https://doi.org/10.1016/j.jhin.2018.06.028.
2 Maillard, J.-Y. and Centeleghe, I. (2023). How biofilm changes our understanding of cleaning and disinfection. Antimicrobial Resistance and Infection Control, [online] 12(1), p.95. doi:https://doi.org/10.1186/s13756-023-01290-4.
3 K Ledwoch, Vickery, K. and Maillard, J-Y. (2022). Dry surface biofilms: what you need to know. British journal of hospital medicine, 83(8), pp.1–3. doi:https://doi.org/10.12968/hmed.2022.0274.