Le dioxyde de chlore (ClO2) est un biocide puissant, dont l’efficacité est prouvée contre un large éventail de micro-organismes, y compris les virus. Des recherches scientifiques ont été menées afin de comprendre son activité virucide et son mode d’action. Plusieurs mécanismes peuvent expliquer l’inactivation virale par le ClO₂, notamment l’altération des protéines et des acides nucléiques. Une meilleure compréhension de son mode d’action permet d’optimiser la conception de produits destinés à la lutte contre les infections.
Introduction
Les virus se situent à la frontière du vivant. Ils sont constitués de matériel génétique, soit de l’acide désoxyribonucléique (ADN), soit de l’acide ribonucléique (ARN), enfermé dans une enveloppe protéique appelée capside. Certains virus possèdent également une enveloppe supplémentaire composée de lipides et de protéines. Ils représentent les plus petits agents infectieux connus. En théorie, 500 millions de rhinovirus (responsables du rhume banal) pourraient tenir sur la pointe d’une épingle (Microbiology Society, 2020) (Figure 1).
Les virus ne peuvent se multiplier que dans les cellules d’autres organismes vivants, appelées cellules hôtes. Ainsi, ils sont considérés comme des parasites intracellulaires obligatoires. Les infections virales provoquent de nombreuses maladies telles que le COVID-19, le virus Ebola, la rougeole, la grippe, l’hépatite, la polio et la variole. La pathogénicité d’un virus dépend de son affinité pour une cellule hôte ainsi que de sa capacité à pénétrer et à se répliquer dans celle-ci. L’inactivation et la destruction des virus présents dans l’environnement immédiat sont essentielles pour réduire le risque d’infection virale. Cela passe principalement par la désinfection et le respect des pratiques de lutte contre les infections.

Figure 1. Comparaison des tailles entre un globule rouge humain et divers micro-organismes. Image adaptée de Royal Society of Biology (https://www.rsb.org.uk/biologist-features/158-biologist/features/1490-larger-than-life).
Le dioxyde de chlore comme désinfectant
Le dioxyde de chlore (ClO2) est utilisé dans l’industrie du traitement de l’eau depuis un siècle. L’Organisation mondiale de la santé (OMS) approuve son usage pour la désinfection de l’eau potable. Depuis plusieurs décennies, il s’est démontré comme un biocide efficace, sous forme de solution et de gaz, contre les bactéries, les virus, les protozoaires, les levures, les champignons, les mycobactéries et les spores bactériennes.
Le ClO2 est un oxydant capable de capter des électrons à partir des molécules avoisinantes, notamment celles des virus. Il peut capter jusqu’à cinq électrons, ce qui le rend plus efficace que d’autres oxydants, comme le chlore aqueux, l’acide peracétique et le peroxyde d’hydrogène, qui ne peuvent capter que deux électrons (Fukayama et al., 1986 ; Miura et Shibata, 2010) (Figure 2).
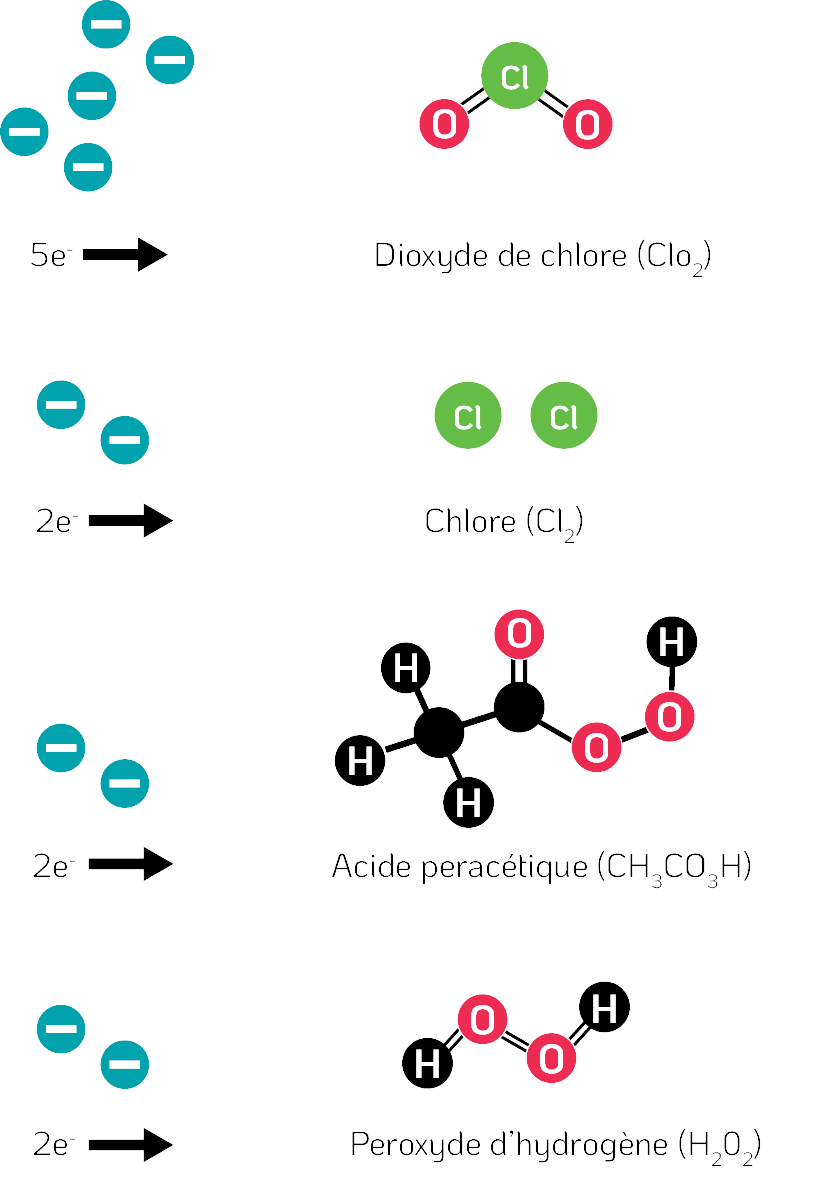
Figure 2. La capacité d’oxydation de divers agents biocides. La capacité d’oxydation des substances chimiques indique le nombre d’électrons qu’une molécule peut capter auprès des molécules de son environnement, y compris des micro-organismes, et les réactions de réduction qui en résultent.
L’activité virucide du dioxyde de chlore
Les virus sont classés en deux catégories : enveloppés et non enveloppés. Selon les Centers for Disease Control and Prevention (CDC), les virus enveloppés sont considérés comme les plus faciles à inactiver par les désinfectants. En revanche, les virus non enveloppés, ainsi que les mycobactéries et les spores bactériennes, sont plus résistants (Centers for Disease Control and Prevention, 2008) (Figure 3).

Figure 3. Résistance des micro-organismes aux désinfectants. Adapté d’après les directives des Centers for Disease Control and Prevention (2008).
Les désinfectants Tristel à base de ClO2 ont été testés conformément aux normes virucides EN 14476 et EN 14675, qui sont les normes réglementaires européennes définissant l’activité virucide des désinfectants utilisés respectivement dans les domaines médical et vétérinaire.
Dans le domaine médical, le norovirus murin, le poliovirus de type 1 et l’adénovirus de type 5 sont sélectionnés par les scientifiques pour les essais, car ils représentent les virus les plus résistants. L’efficacité contre ces virus et la conformité à la norme EN 14476 permettent de déduire une efficacité contre l’ensemble des virus, qu’ils soient enveloppés ou non enveloppés.
Dans le domaine vétérinaire, l’entérovirus bovin de type 1 est choisi comme le virus test le plus résistant, garantissant ainsi une efficacité contre tous les virus.
Une partie des désinfectants Tristel à base de ClO2 est également conforme aux directives de l’Agence américaine de protection de l’environnement (EPA – Environmental Protection Agency), selon la méthode ASTM E1053.
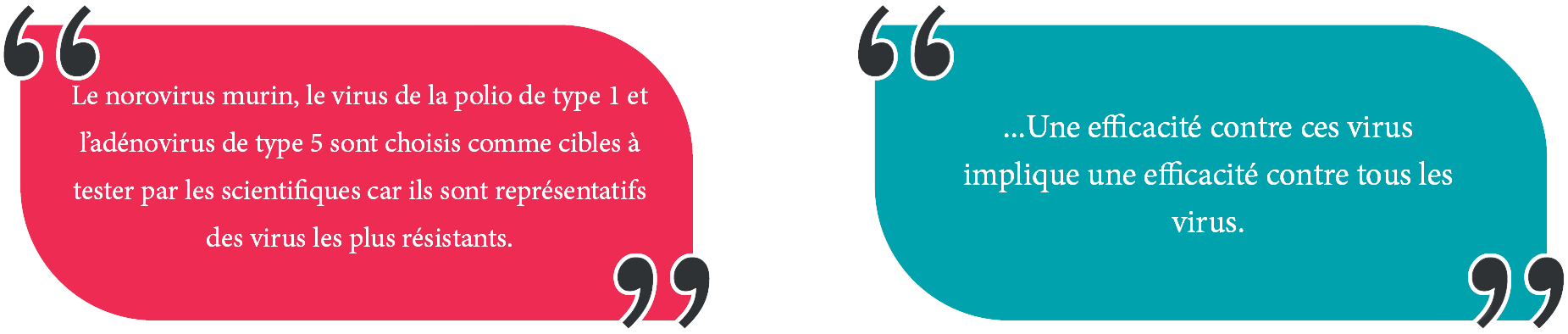
Les produits Tristel à base de ClO2 figurent dans des études sur la lutte contre les infections dues au HPV (Human Papillomavirus) et au SRAS-CoV-2 (le virus responsable de la pandémie de COVID-19). Meyers et al. (2020) démontrent que les produits Tristel à base de ClO2, notamment Tristel Duo et Tristel Trio Wipes System, sont efficaces contre les HPV infectieux de types 16 et 18 sur des dispositifs médicaux (sondes d’échographie endocavitaires et nasofibroscopes), en 30 secondes de temps de contact.
Dans l’étude de Jerry et al. (2020), le produit Tristel Fuse for Surfaces (également à base de ClO2) a été utilisé dans le processus de décontamination des chambres de patients atteints de COVID-19, des salles de traitement et des postes de soins infirmiers. Cette étude démontre que l’utilisation du ClO2, en complément d’autres mesures, est efficace pour prévenir la propagation du SRAS-CoV-2 à partir des chambres de patients et des zones des services généraux contaminés.
Dioxyde de chlore, mécanisme d’inactivation virale
Le ClO2 réagit avec les composants viraux, notamment les protéines (chaînes de résidus d’acides aminés) et le matériel génétique (acides nucléiques). Ces réactions affectent les virus et entraînent leur inactivation par différents mécanismes. La communauté scientifique poursuit ses recherches sur le mode d’action du ClO2 et sur la manière dont cette molécule active interagit spécifiquement avec les structures virales.
Mode d’action sur les protéines virales
Contrairement à d’autres oxydants chimiques, le ClO2 est très sélectif. Il réagit extrêmement lentement (voire pas du tout) avec la plupart des composés organiques, notamment les tissus vivants, qui sont connus pour inactiver d’autres oxydants chimiques tels que le chlore aqueux. Cependant, le ClO2 interagit spécifiquement avec certains acides aminés, à savoir la cystéine, la méthionine, la tyrosine et le tryptophane, qu’il modifie par oxydation (Noszticzius et al., 2013).
Ogata et Shibata (2008) ont démontré que le traitement au ClO2 entraîne la dénaturation de l’hémagglutinine (HA) et de la neuraminidase (NA), présentes sur le virus de la grippe (Influenza A). Quatre peptides modèles (HA1, HA2, NA1 et NA2) ont été traités avec du ClO2 et analysés par chromatographie liquide haute performance (HPLC) en phase inverse. Le chromatogramme a révélé plusieurs nouveaux pics peptidiques, différents de ceux d’origine. Il en a été déduit que les peptides initiaux avaient été modifiés de manière covalente par réaction avec le ClO2. Cette modification covalente des résidus d’acides aminés du tryptophane et de la tyrosine a été confirmée par spectroscopie de masse (MS). Ces altérations des résidus d’acides aminés ont provoqué la dénaturation des protéines HA et NA du virus de la grippe. Ces protéines étant essentielles à l’infectiosité du virus, leur dénaturation a conduit à son inactivation.
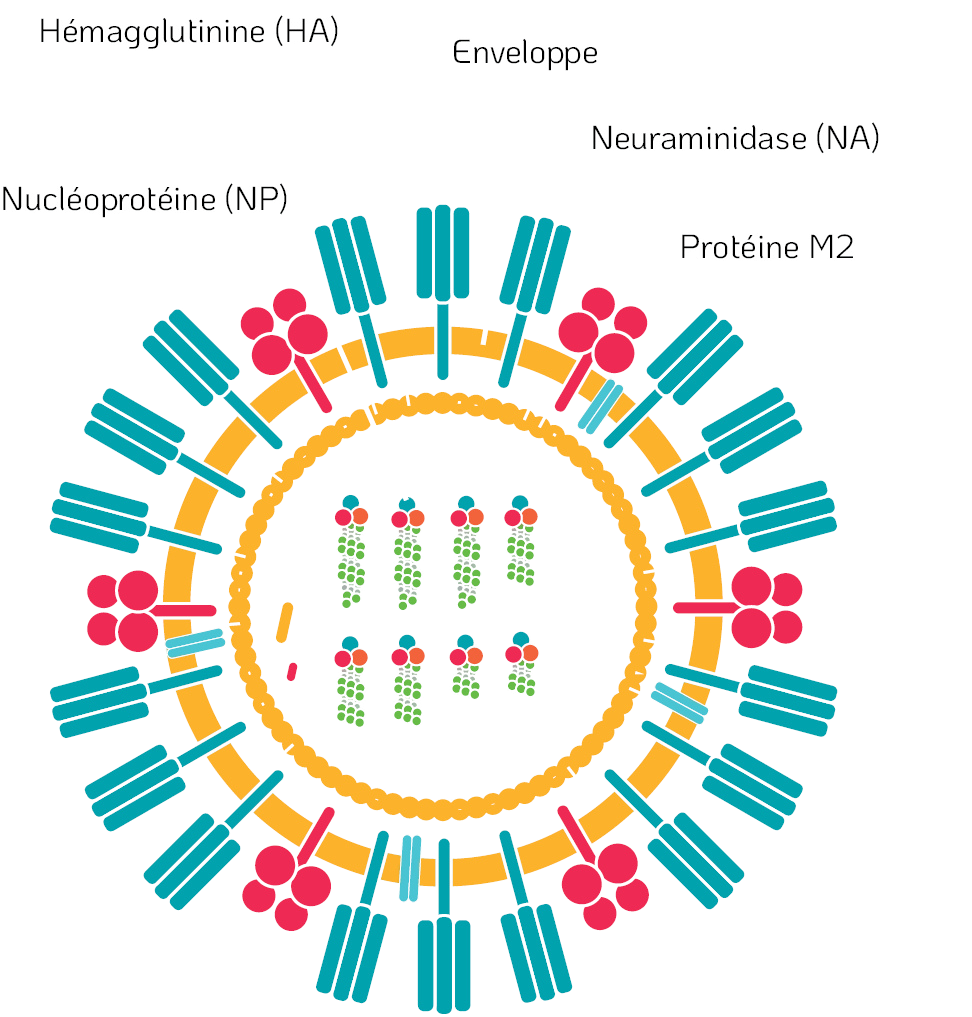
Figure 4. Structure d’un virus enveloppé – Virus de la grippe.
Il a été constaté que d’autres peptides avaient également été modifiés au niveau des résidus de tryptophane et de tyrosine. Cette modification a également été suggérée pour d’autres protéines vitales, telles que la protéine Matrix-2 (M2) présente dans l’enveloppe virale.
La protéine M2 du virus de la grippe (Influenza A) forme un canal protonique qui régule le pH à travers la membrane virale lors de l’entrée du virus dans la cellule hôte, déclenchant ainsi la libération du génome viral et permettant la réplication du virus (Cady et al., 2009). Un résidu de tryptophane, situé dans le canal de la protéine M2, agit comme un portail pour le passage des protons. Étant donné que le ClO2 réagit avec le tryptophane dans divers peptides, il est probable que le résidu de tryptophane du canal de la protéine M2 ait également été modifié par le ClO2, entraînant ainsi l’altération de sa fonctionnalité essentielle (Figure 5).
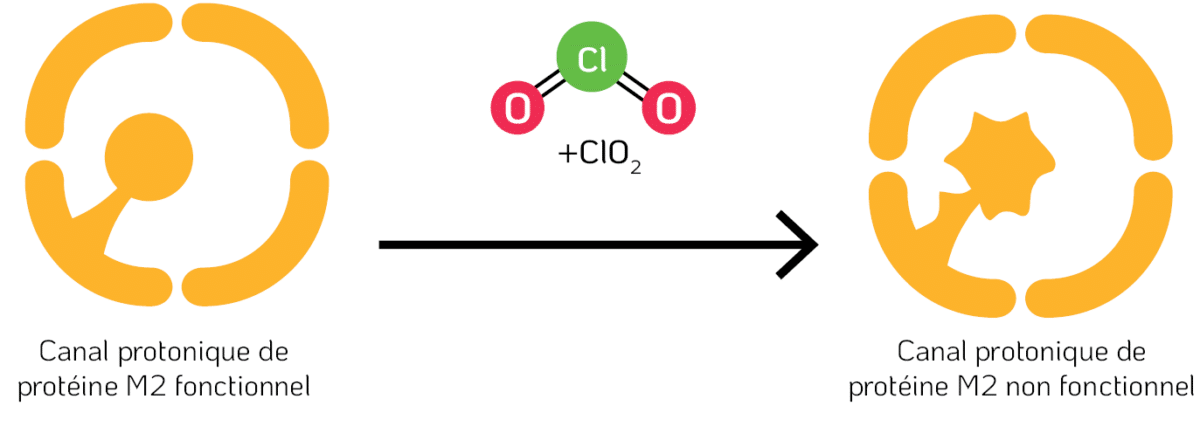
Figure 5. Dénaturation de la protéine Matrix-2 (M2) par le ClO2. La protéine M2 est une viroporine (canal ionique) sélective des protons située dans l’enveloppe virale du virus de la grippe (Influenza A). Un résidu de tryptophane (Trp) joue un rôle clé en servant de portail pour le transport des protons.
Mode d’action sur le génome viral
Une étude menée par Alvarez et O’Brien (1982) a conclu que le ClO2 inactive les virus de la polio (virus non enveloppés) en ciblant leur ARN viral, compromettant ainsi la capacité du génome viral à servir de modèle pour la réplication. L’analyse de la sédimentation d’extraits de cellules HeLa infectées par des virus inactivés par le ClO2 a révélé une incorporation réduite de l’uridine (l’une des quatre bases constituant l’ARN) dans le nouvel ARN viral. Dans cette étude, l’ARN viral a été identifié comme la cible critique du ClO2, entraînant l’incapacité du virus à se répliquer (Figure 6).

Figure 6. Molécules de ClO2 infiltrant un virus non enveloppé (notamment le virus de la polio) et réagissant avec son ARN (image adaptée d’après Thurman et Gerba, 1988).
Il a également été observé que le ClO2 inactive un autre virus non enveloppé, le virus de l’hépatite A (VHA), en détruisant simultanément son antigénicité et en endommageant son génome viral. L’antigénicité correspond à la capacité d’un antigène (situé sur la capside du VHA) à se lier spécifiquement à une protéine complémentaire, notamment aux récepteurs des cellules hôtes.
Dans l’étude de Li et al. (2004), l’antigénicité a été mesurée par ELISA (enzyme-linked immunosorbent assay), et le génome viral a été analysé par RT-PCR (reverse transcription polymerase chain reaction) à chevauchement long, révélant que la région 5’ non traduite avait été endommagée par le ClO2. L’étude a conclu que le ClO2 réagissait à la fois avec l’ARN viral et avec la protéine de capside virale, empêchant ainsi le VHA de se fixer, de pénétrer et de se répliquer dans les cellules hôtes (Figure 7).

Figure 7. Molécules de ClO2 réagissant avec les antigènes du VHA et son ARN, entraînant des modifications altérant son infectiosité (image adaptée d’après Thurman et Gerba, 1988).
Le virus de la polio et le VHA sont tous deux des virus non enveloppés, reconnus comme les plus résistants aux désinfectants. L’efficacité du ClO2 contre ces virus suggère une efficacité similaire contre d’autres virus de structure comparable, ainsi que contre les virus enveloppés, généralement plus sensibles aux désinfectants.
Conclusion
L’activité virucide du dioxyde de chlore a été solidement établie par les études susmentionnées ainsi que par des tests d’efficacité virale conformes aux normes européennes et américaines. Ces avancées ont permis à l’industrie de développer des désinfectants spécifiquement adaptés à la lutte contre les infections virales.
Le principe actif de nombreux produits Tristel repose sur une formulation unique de dioxyde de chlore. Ces produits font partie de la gamme Tristel dédiée à la désinfection de haut niveaux des dispositifs semi-critiques, incluant les Tristel Trio Wipes System, Tristel Duo ULT et Tristel Duo OPH, Tristel Duo ORL ainsi que la gamme Cache, qui comprend des détergents et des désinfectants pour les surfaces, notamment les produits JET et FUSE.
Diverses études ont démontré que le dioxyde de chlore interagit avec les virus en fonction de leur composition moléculaire et de leur structure. À mesure que les recherches progressent, ces mécanismes seront mieux compris et précisés.
Pour voir les références, consultez le PDF. ©2025 Tristel Solution Limited. All rights reserved.
Articles associés
Nous passons la norme EN 17846 !
Qu’est-ce que la norme EN 17846 et pourquoi est-elle essentielle ? La norme EN 17846 est une norme européenne récente qui définit les exigences et les méthodes d’essai pour évaluer […]
En savoir plusSous le Microscope – HPV
Les papillomavirus humains (HPV) sont de petits virus à ADN non enveloppés responsables d’une gamme de pathologies allant des verrues bénignes aux cancers. Plus de 200 types de HPV ont […]
En savoir plusWebinaire: Combattre la résistance aux antimicrobiens
Vous avez manqué notre webinaire en direct ? Pas de problème ! Vous pouvez désormais le regarder en replay. 💡 Sujet: Une approche proactive de la désinfection peut-elle aider à […]
En savoir plus