High-Level-Desinfektion von Transvaginalen Ultraschallsonden
Was sind TVUS-Sonden?TVUS-Sonden sind transvaginale Ultraschallsonden, welche hochfrequente Schallwellen zur Erzeugung von Bildern im Beckenbereich verwenden1. Sie ermöglichen Untersuchungen der weiblichen Fortpflanzungsorgane wie Vagina, Muttermund, Gebärmutterhals (Zervix) und -höhle, Eileiter und Eierstöcke und helfen bei der Erkennung und Diagnose von Erkrankungen1. TVUS-Untersuchungen erfolgen innerhalb des Körpers und beinhalten das Einführen der Sonde ind die Scheide1. |
 |
Warum ist für TVUS-Sonden eine High-Level-Desinfektion erforderlich?
1. Offizielle Empfehlungen und Leitlinien zur Aufbereitung von Sonden befürwortet die High-Level-Desinfektion
Weltweite Empfehlungen zur Desinfektion oder Sterilisation von Medzinprodukten folgen der Spaulding-Klassifikation. Diese Klassifizierung basiert auf dem Infektionsrisiko für Patienten unter Berücksichtigung der bestimmungsgemäßen Verwendung des Medizinprodukts2 . TVUS-Sonden kommen beim Einführen in die Patientin mit der Schleimhaut des Gebärmutterhalses und der Vaginalwand in Kontakt. Analog der Spaulding-Klassifizierung wird daher eine High-Level-Desinfektion empfohlen (Tabelle 1.)2.
Die deutsche Klassifizierung findet sich in den „Anforderungen an die Hygiene bei der Aufbereitung von Medizinprodukten”26. Für semikritisch A Medizinprodukte wird eine Desinfektion mit Wirkungsbereich bakterizid, mykobakterizid, fungizid und viruzid gefordert. Der Verbund für Angewandte Hygiene (VAH) empfiehlt zudem eine sporizide Wirksamkeit des Desinfektionsmittels bei Sonden, die im Rektalbereich Anwendung finden27 .
Table 1. Die Spaulding Klassifikation²
2. Risiken durch Mikroperforationen & Undichtigkiet der Sonden-Schutzhülle
Die Verwendung von Sonden-Schutzhüllen wird weltweit zur Minimierung der Kontamination bei der Durchführung von TVUS-Verfahren befürwortet3–12 . Dennoch kann es durch Mikroperforationen, teilweiser oder vollständiger Durchbrechung der Schutzhülle oder durch falsche Platzierung zu Kontaminationen kommen (siehe Abbildung 1.). Einige kommerziell hergestellte Schutzhüllen für Ultraschallsonden weisen inakzeptabel hohe Undichtigkeitsraten von bis zu 81 % auf und stellen keine zuverlässige Barriere gegen infektiöse Erreger, insbesondere Viren, dar13 .
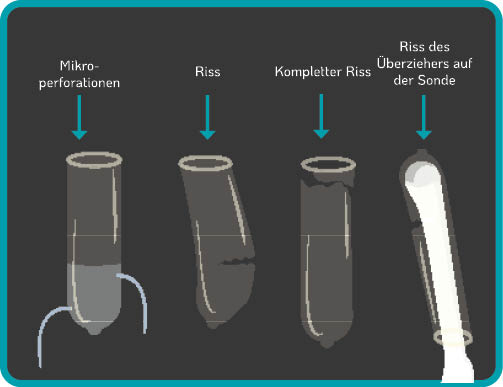
Verunreinigungen konnten selbst dann festgestellt werden, wenn eine TVUS-Sonde mit einer Schutzhülle abgedeckt und danach mit einem intermediären oder Low-Level-Desinfektionsmittel desinfiziert wurde14-17 . Wenn eine TVUS-Sonde zwischen den Einsätzen am Patienten unzureichend desinfiziert wird oder die Schutzhülle beschädigt ist/falsch platziert wird (siehe Abbildung 1.), kann es zu einer nosokomialen Übertragung von Patient zu Patient oder vom Patienten zum medizinischen Personal kommen. Die Anwendung von Desinfektionsmitteln mit unzureichender Wirksamkeit reduziert die Keimbelastung nicht auf ein sicheres Maß. Krankheitserreger können auch über einen längeren Zeitraum infektiös bleiben, wenn eine Fläche oder ein Medizinprodukt nicht ausreichend desinfiziert wurde5 . Zum Beispiel kann das Humane Papillomavirus (HPV) bis zu sieben Tage auf Oberflächen überleben18 .
3. Verschmutzung an TVUS-Sonden, -Kabeln und -Steckern
|
Zu den Komponenten von TVUS-Sonden (Abbildung 2.), bei denen das Risiko einer Blut- und Mikrobenkontamination besteht, gehören: Eine High-Level-Desinefktion verhindert die Ausbreitung von schädlichen Krankheitserregern von einer Patientin zur anderen und schützt gelichzeitig das medizinische Personal während der Behandlung. Einige Automaten zur maschinellen Desinfektion sind nur in der Lage, den Einführteil und den Griff der TVUS-Sonde zu desinfizieren. Das Tristel Trio Wipes System und Tristel Duo ULT ermöglichen eine High-Level-Desinfektion von allen Teilen der TVUS-Sonde, einschließlich des Kabels, des Steckers und des Sondenhalters. |
|
4. Gefahr durch bakterielle Sporen aus der Umgebung
Bakterielle Sporen wie Bacillus subtilis sind häufig in der Patientenumgebung zu finden22. Da TVUS-Sonden nicht in einem sterilen Bereich gelagert oder aufbereitet werden müssen, besteht die Gefahr, dass sie rekontaminiert werden. Bakterielle Sporen gelten als die gegenüber Desinfektionsmitteln resistentesten Mikroorganismen (Abbildung 3). Die hohen Temperaturen und aggressiven Chemikalien, die bei der Sterilisation verwendet werden würden, könnten jedoch die Sonde beschädigen, weshalb eine High-Level-Desinfektion die sicherste Alternative darstellt.
Abbildung 3. Resistenz von Mikroorganismen gegen Desinfektionsmittel. Angepasst von Centers for Disease Control and Prevention (2008)2
Inaktivierung von Krebserregenden Humanen Papillomaviren auf TVUS-Sonden
Die Society for Maternal-Fetal Medicine (2020) hat kürzlich eine Leitlinie zur Patientensicherheit zur Reduzierung des Risikos einer Infektionsübertragung durch TVUS-Untersuchungen veröffentlicht und empfiehlt Folgendes:
• die Verwendung von sterilen Einweg-Sonden-Schutzhüllen bei jeder TVUS-Untersuchung13.
• die Verwendung von sterilen Einweg-Ultraschallgel-Sachets13.
• die vorhergehende Reinigung von TVUS-Sonden, d. h. die Entfernung grober Verunreinigungen wie Gel und Ablagerungen, die die Wirksamkeit von Desinfektionsmitteln verringern können, nach jeder Untersuchung13.
• eine High-Level-Desinfektion mit einem Mittel mit nachgewiesener Wirksamkeit gegen HPV13.
Bis vor Kurzem war es nicht möglich, die Wirksamkeit von Desinfektionsmitteln gegen native HPV zu testen. In Ermangelung verfügbarer Methoden bezogen sich die Prüfnormen auf das Surrogat-Polyomavirus SV40, welches als Indikator für die Wirksamkeit gegen HPV verwendet wurde. Die Resistenzprofile der beiden Viren gegen Desinfektionsmittel sind jedoch nicht im Vergleich untersucht worden. Dies bedeutet, dass eine Wirksamkeit gegen das Surrogat-Polyomavirus SV40 nicht unbedingt eine Wirksamkeit gegen HPV impliziert23.
Neue wissenschaftliche Untersuchungen von Meyers et al. (2020) zeigen, dass das Tristel Trio Wipes System und Tristel Duo ULT bei einer Einwirkzeit von 30 Sekunden auf einer transvaginalen Ultraschallsonde wirksam gegen die infektiösen Hochrisiko-HPV-Typen 16 und 18 sind24.
 |
Tristel Trio Wipes SystemDer Goldstandard für die manuelle Aufbereitung von invasiven und nicht invasiven Medizinprodukten ohne Kanal. 30 Sekunden Einwirkzeit Klicken Sie hier, umd mehr über Tristel Trio Wipes System zu erfahren. |
|
|
|
Tristel Duo ULTEin Schaum für die High-Level-Desinfektion intrakavitärer Ultraschallsonden und transkutaner Schallköpfe, einschließlich Kabeln, Steckern und Ultraschalleinheit. 30 Sekunden Einwirkzeit Klicken Sie hier, um mehr über Tristel Duo ULT zu erfahren. |
Quellenangaben
1. NHS. 2018. Ultrasound Scan. [online] Available at: <https://www.nhs.uk/conditions/ultrasound-scan/> [Abgerufen am 3 Oktober 2020].
2. Centers for Disease Control and Prevention (2008) Guideline for Disinfection and Sterilization in Healthcare Facilities, 2008 Available at: https://www.cdc.gov/infectioncontrol/pdf/guidelines/disinfection-guidelines-H.pdf [Abgerufen am 3 Oktober 2020]
3. Abramowicz JS, Evans DH, Fowlkes JB, Marsal K, TerHaar G, on behalf of the WFUMB Safety Committee. Guidelines for cleaning transvaginal ultrasound transducers between patients. Ultrasound in Med & Biol, 2017; 43(5):1076-1079.
4. EFSUMB (European Federation of Societies for Ultrasound in Medicine and Biology) -2017; http://www.efsumb.org/safety/resources/2017-probe_cleaning.pdf.
5. Prevention Du Risque Infectieux Associe Aux Actes D’echographie Endocavitaire https://solidarites-sante.gouv.fr/IMG/pdf/fiches_sondes.pdf.
6. Nyhsen, C., Humphreys, H., Koerner, R., Grenier, N., Brady, A., Sidhu, P., Nicolau, C., Mostbeck, G., D’Onofrio, M., Gangi, A. and Claudon, M., 2017. Infection prevention and control in ultrasound – best practice recommendations from the European Society of Radiology Ultrasound Working Group. Insights into Imaging, 8(6), pp.523-535.
7. Guidelines for reprocessing ultrasound transducers AJUM, 2017, 20;1:30-40.
8. BMUS / SOR (British Medical Ultrasound Society / Society and College of Radiology) -2017; https://www.bmus.org/policies-statements-guidelines/professional-guidance/guidelines-for-professional-ultrasound-practice/
9. Irish Health Service Executive (HSE) Quality Improvement Division – Decontamination Safety Programme (2017) HSE guidance for decontamination of semi‐critical ultrasound probes; Semi‐invasive and Non‐invasive Ultrasound Probes QPSD-GL-028-1 http://wwwhseie/eng/about/Who/QID/nationalsafetyprogrammes/decontamination/Ultrasound-Probe-Decontamination-Guidance-Feb-17pdf
10. Health Facilities Scotland Decontamination Services (2016) NHS Scotland guidance for decontamination of semi-critical ultrasound probes; semi-invasive and non-invasive ultrasound probes http://wwwhpsscotnhsuk/documents/hai/infectioncontrol/guidelines/NHSScotland-Guidance-for-Decontaminationof-Semi-Critical-Ultrasound-Probespdf
11. Guidelines for Reprocessing Ultrasound Transducers by the Australasian Society for Ultrasound in Medicine and the Australasian College for Infection Prevention and Control (2017) AJUM 20 (1) http://onlinelibrary.wiley.com/doi/10.1002/ajum.12042/epdf
12. Rutala WA, Weber D. Reprocessing semicritical items. Am J Infect Control. 2016;44:e53–e62. doi: 10.1016/j.ajic.2015.12.029.
13. Hamm, R., Combs, C. and Davidson, C., 2020. Society for Maternal-Fetal Medicine Special Statement: Reducing the risk of transmitting infection by transvaginal ultrasound examination. American Journal of Obstetrics and Gynecology, 223(3), pp.B2-B6.
14. M’Zali, F., Bounizra, C., Leroy, S., Mekki, Y., Quentin-Noury, C., Kann, M. (2014) ‘Persistence of MicrobialContamination on Transvaginal Ultrasound Probes despite Low-Level Disinfection Procedure’, PLoS ONE, vol. 9, no. 4 [Online]. DOI: 10.1371/journal.pone.0093368 (Abgerufen am 17 Juni 2018).
15. Ma, S., Yeung, A., Chan, P., Graham, C. (2014) High level disinfection reduces HPV contamination of transvaginal sonography probes in the emergency department [Online]. Available at: https://emj.bmj.com/content/30/6/472.responses#high-level-disinfection-reduces-hpv-contamination-of-transvaginal-sonography-probes-in-the-emergency-department (Abgerufen am 26 Juli 2018).
16. Casalegno, JS., Carval, K., Eibach, D., Valdeyron, ML., Lamblin, G., Jacquemoud, H., Mellier, G., Lina, B., Gaucherand, P., Mathevet, P., Mekki1, Y. (2012) ‘High Risk HPV Contamination of Endocavity Vaginal Ultrasound Probes: An Underestimated Route of Nosocomial Infection?’, PLoS ONE, vol. 7, no. 10 [Online]. DOI: doi:10.1371/journal.pone.0048137 (Abgerufen am 23 Juni 2018).
17. Strauss, S., Sastry, P., Sonnex, C., Edwards, S, Gray, J. (2002) ‘Contamination of environmental surfaces by genital human papillomaviruses’,
18. Roden, R., Lowy, D., Schiller, J. (1997) ‘Papillomavirus Is Resistant to Desiccation’, The Journal of Infectious Diseases, vol. 176, no. 5., pp. 1076-1079 [Online] DOI: https://doi.org/10.1086/516515
19. Basseal, J., Westerway, S. and Hyett, J., 2020. Analysis of the integrity of ultrasound probe covers used for transvaginal examinations. Infection, Disease & Health, 25(2), pp.77-81
20. Westerway, S. C., Basseal, J. M., Brockway, A., Hyett, J. A., Carter, D. A. (2016) ‘Potential Infection Control Risks Associated with Ultrasound Equipment – A Bacterial Perspective’, Ultrasound in Medicine & Biology [Online] DOI: 10.1016/j.ultrasmedbio.2016.09.004 (Accessed 25 Oktober 2018).
21. Keys, M., Sim, B., Thom, O., Tunbridge, M., Barnett, A., Fraser, J. (2015) ‘Efforts to Attenuate the Spread of Infection (EASI): a prospective, observational multicentre survey of ultrasound equipment in Australian emergency departments and intensive care units’, Critical care and resuscitation, vol. 17, no. 1, pp. 43-46 [Online]. Available at: https://www.ncbi.nlm.nih.gov/pubmed/25702761 (Accessed 04 April 2019).
22. Allos, B.M., Blaser, M.J., Platts-Mills, J. and Kosek, M., 2014. Campylobacter Species – Infectious Disease and Antimicrobial Agents. [online] Antimicrobe.org. Available at: http://www.antimicrobe.org/new/b91.asp [Abgerufen am 5 August 2020].
23. Meyers, J., Ryndock, E., Conway, M., Meyers, C. and Robison, R., 2014. Susceptibility of high-risk human papillomavirus type 16 to clinical disinfectants. Journal of Antimicrobial Chemotherapy, 69(6), pp.1546-1550.
24. Meyers, C., Milici, J., Robison, R. (2020) ‘The Ability of Two Chlorine Dioxide Chemistries to Inactivate Human Papillomavirus-contaminated Endocavitary Ultrasound Probes and Nasendoscopes’. Published IN THE JOURNAL OF MEDICAL VIROLOGY [Online] Available at: bit.ly/HPVARTICLE
25. World Health Organization. 2018. Human Papillomavirus (HPV). [online] Available at: <https://www.who.int/immunization/diseases/hpv/en/> [Abgerufen am 19 Oktober 2020].
©2021 Tristel Solution Limited. Alle rechte vorbehalten.
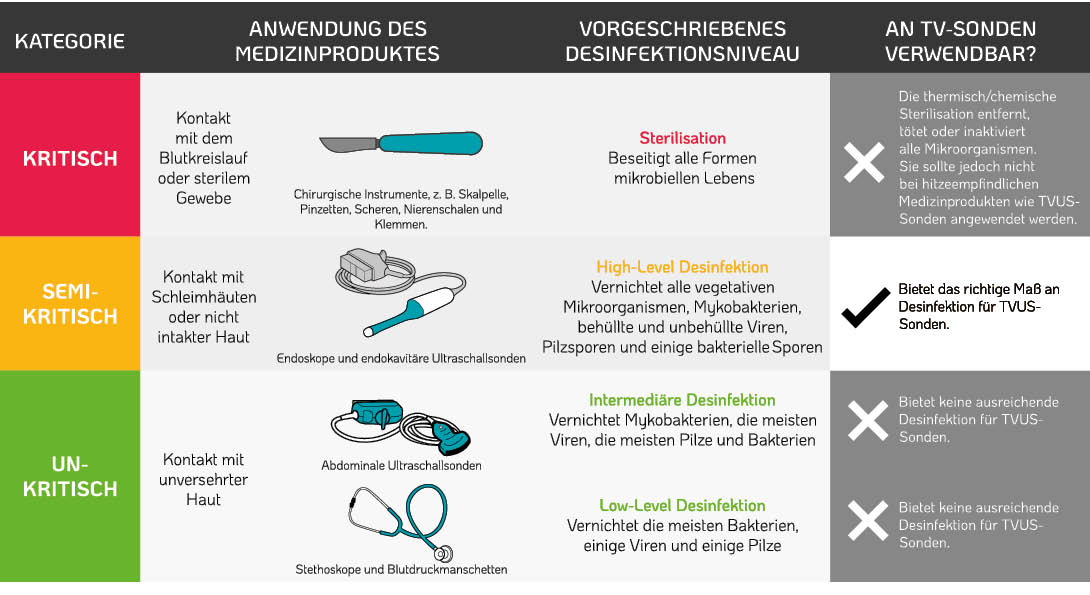
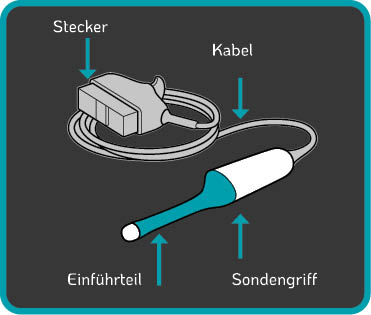 Abbildung 2. Standardkomponenten einer TVUS-Sonde
Abbildung 2. Standardkomponenten einer TVUS-Sonde

