La chimie Tristel ClO₂ : mode d’action sur les virus
La chimie Tristel ClO₂ : mode d’action sur les virus ?
MOTS-CLÉS ET ACRONYMES
ClO₂ – Dioxyde de chlore
Modification covalente – Altérations de protéines de synthèse, y compris l’ajout et/ou le retrait de groupes chimiques
ADN – Acide désoxyribonucléique
ELISA (Enzyme-linked immunosorbent assay) – Test de biochimie analytique pour la détection d’antigènes dans un
échantillon
HA (hémagglutinine) – Protéine présente à la surface des virus de la grippe, qui fait partie intégrante de son infectiosité pour
les cellules hôtes
Cellules HeLa – Lignée cellulaire immortelle utilisée dans la recherche scientifique, dérivée de cellules cancéreuses du col de
l’utérus prélevées chez une patiente du nom d’Henrietta Lacks
Cellule hôte – Cellule vivante dans laquelle un virus se multiplie
Protéine M2 – La protéine de matrice 2 est une viroporine (formant canal), sélective pour les protons, présente dans
l’enveloppe virale du virus de la grippe (Influenza A)
NA (Neuraminidase) – Enzyme se trouvant à la surface des virus de la grippe, essentielle pour la libération de la
descendance du virus à partir d’une cellule hôte infectée
Pathogénicité – Capacité d’un microbe à provoquer une maladie/des dommages chez un hôte
Proton – Une particule subatomique, ayant une seule charge électrique positive. Également connu sous le nom d’ion
hydrogène (H+)
HPLC (High Performance Liquid Chromatography) en phase inverse – Technique de séparation d’un mélange à l’aide
d’une phase stationnaire non polaire
ARN – Acide ribonucléique
RT-PCR (Reverse transcription polymerase chain reaction- Une technique combinant la transcription inverse de l’ARN
dans l’ADN et l’amplification de cibles spécifiques de l’ADN par réaction en chaîne de la polymérase
Analyse de la sédimentation – L’analyse des composants viraux par la centrifugation de cellules HeLa
Résumé
Le dioxyde de chlore (ClO₂) est un biocide puissant avec une efficacité prouvée contre un large éventail de micro-organismes, y compris les virus. Des recherches scientifiques ont été entreprises pour comprendre l’activité virucide et le mode d’action du dioxyde de chlore. Plusieurs voies identifiées peuvent expliquer l’inactivation virale par le ClO₂, y compris une altération des protéines et de l’acide nucléique. La compréhension du mode d’action du ClO₂ permet de faire progresser la mise au point de produits utilisés dans la lutte contre les infections.
Introduction
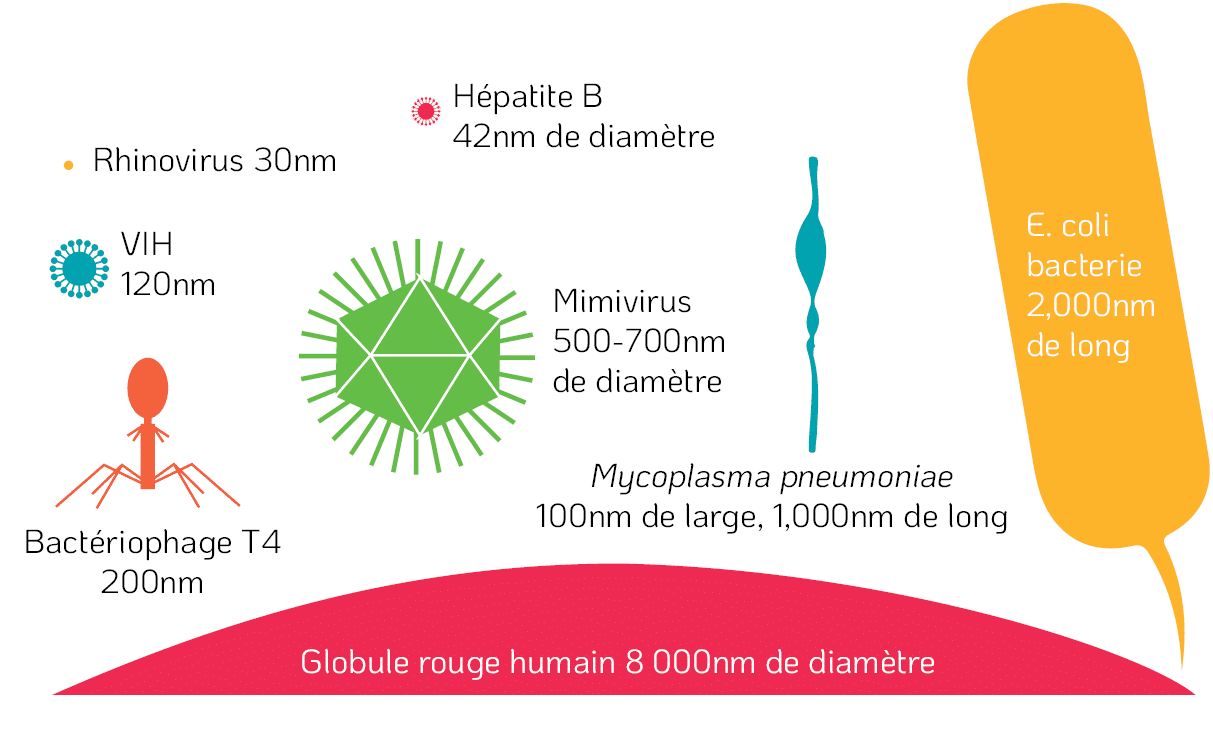
Les virus sont en équilibre sur la frontière de ce que l’on peut considérer comme des organismes vivants. Les virus sont composés de matériel génétique, soit de l’acide désoxyribonucléique (ADN), soit de l’acide ribonucléique (ARN), entouré d’une enveloppe protéique appelée capside. Certains virus sont recouverts d’une enveloppe supplémentaire composée de lipides et de protéines appelée capside. Les virus sont les plus petits de tous les agents infectieux. Théoriquement, 500 millions de rhinovirus (cause du rhume banal) pourraient tenir sur la tête d’une épingle (Microbiology Society, 2020) (Figure 1).
Les virus ne peuvent se multiplier que dans les cellules d’autres organismes vivants, que l’on appelle donc des cellules hôtes. C’est pourquoi ces virus sont considérés comme des parasites obligatoirement intracellulaires. Les infections virales entraînent une myriade de maladies telles que le COVID-19, le virus Ebola, la rougeole, la grippe, l’hépatite, la polio et la variole. La pathogénicité d’un virus chez l’homme est déterminée par l’affinité du virus pour une cellule hôte ainsi que sa pénétration et sa réplication dans cette cellule. L’inactivation et la destruction des virus dans l’environnement immédiat sont essentielles pour réduire le risque d’infection virale. Cela se fait principalement par la désinfection et le respect des pratiques de lutte contre les infections, lorsqu’elles sont applicables.
Figure 1. Comparaison de taille entre un globule rouge humain et divers micro-organismes (https://www.rsb.org.uk/biologist-features/158-biologist/features/1490-larger-than-life).
Le ClO₂ comme désinfectant
Le dioxyde de chlore (ClO₂) est utilisé dans l’industrie du traitement de l’eau depuis un siècle. L’Organisation mondiale de la santé (OMS) approuve le ClO₂ pour la désinfection de l’eau potable. Au cours des dernières décennies, le ClO₂ s’est révélé être un biocide efficace sous forme de solution et de gaz contre les bactéries, les virus, les protozoaires, les levures, les champignons, les mycobactéries et les spores bactériennes.
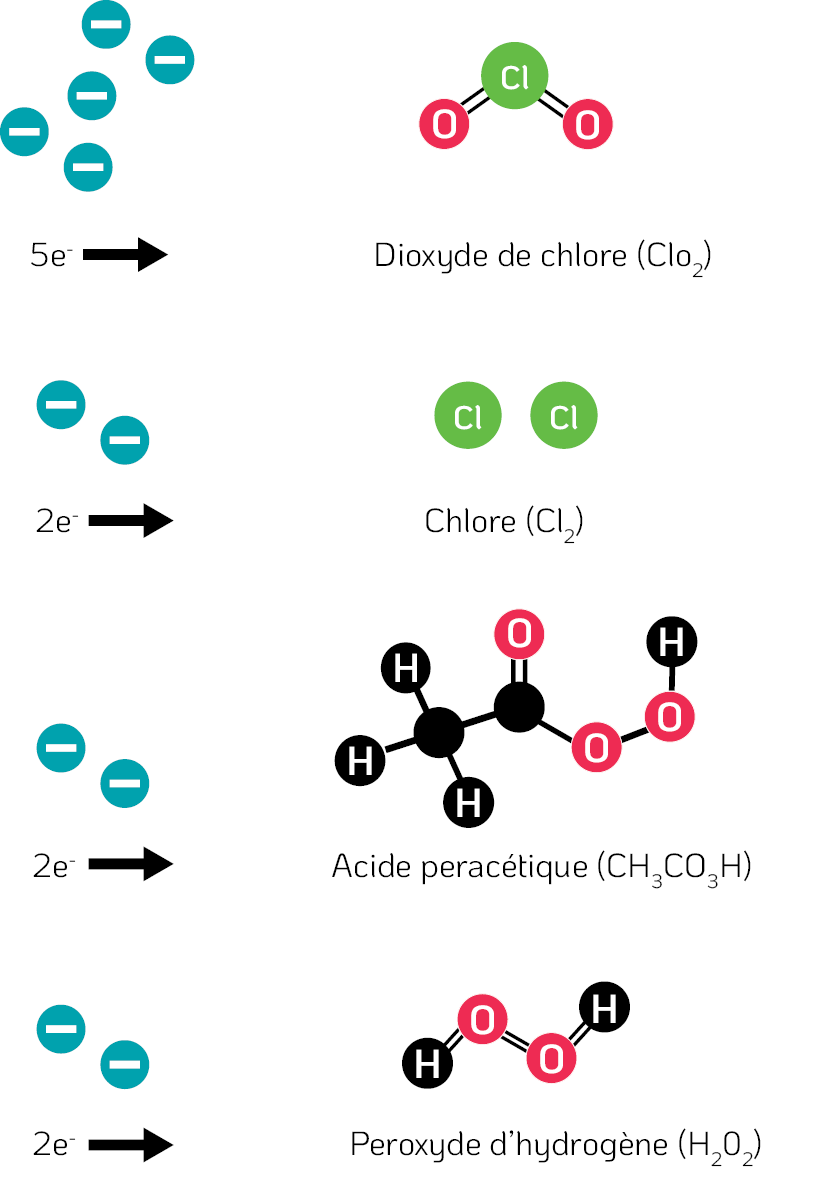
Le ClO₂ est un oxydant, car il a la capacité d’obtenir des électrons à partir de molécules proches, c’est-à-dire les virus. Le ClO₂ peut obtenir cinq électrons au total à partir des molécules qui l’entourent, ce qui en fait un biocide supérieur aux autres oxydants, comme le chlore aqueux, l’acide peracétique et le peroxyde d’hydrogène, qui ne peuvent gagner que deux électrons (Fukayama et al., 1986) (Miura et Shibata, 2010) (figure 2).
Figure 2. La capacité d’oxydation de divers agents biocides. La capacité d’oxydation des substances chimiques indique le nombre d’électrons qu’une molécule peut obtenir des molécules de son environnement, c’est-à-dire les micro-organismes, y compris les réductions en plusieurs parties.
L’activité virucide du ClO₂
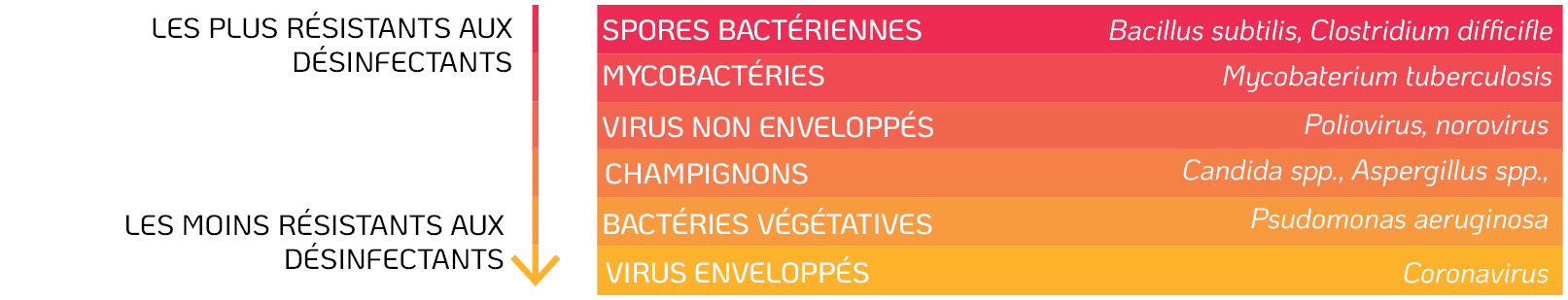
les virus sont soit enveloppés, soit non enveloppés. Selon les CDC (Centers for Disease Control and Prevention), les virus enveloppés sont considérés par les scientifiques comme le groupe de micro-organismes le moins résistant à inactiver pour les désinfectants. Les bactéries végétatives, les champignons, les virus non enveloppés, les mycobactéries et les spores bactériennes sont tous jugés plus résistants à l’inactivation par les désinfectants (Centers for Disease Control and Prevention, 2008) (Figure 3).
Figure 3. Résistance des micro-organismes aux désinfectants. Adapté d’après les directives des Centers for Disease Control and Prevention (2008).
Les désinfectants de Tristel à base de ClO₂ ont été testés conformément aux normes virucides telles que les normes EN 14476 et EN 14675, qui sont les normes réglementaires européennes relatives à l’activité virucide des désinfectants utilisés respectivement dans le domaine médical et vétérinaire.
Dans le domaine médical, le norovirus murin, le virus de la polio de type 1 et l’adénovirus de type 5 sont choisis par les scientifiques pour être testés, car ils sont représentatifs des virus les plus résistants. L’efficacité contre ces virus et le respect de la norme EN 14476 permettent de déduire une efficacité contre tous les virus (non enveloppés et enveloppés).
Dans le domaine vétérinaire, l’entérovirus bovin de type 1 est choisi comme le virus test le plus résistant pour son efficacité contre tous les virus.
Une gamme de désinfectants Tristel à base de ClO₂ est également conforme aux directives de l’Agence américaine de protection de l’environnement (EPA, Environmental Protection Agency) selon la méthode ASTM E1053.
Les produits Tristel à base de ClO₂,figurent dans les études de lutte contre les infections due à l’HPV, ou Human Papillomavirus, et au SRAS-CoV-2 (le virus responsable de la pandémie du COVID-19). Meyers, et al. (2020) démontrent que les produits Tristel à base de ClO₂, Tristel Duo et les lingettes Tristel Trio Wipes System, sont efficaces contre les HPV infectieux de type 16 et 18 sur les dispositifs médicaux [sondes d’échographie endocavitaires et nasofibroscopes] moyennant un temps de contact de 30 secondes.
Dans l’étude de Jerry et al. (2020), le produit Tristel Fuse for Surfaces (également à base de ClO₂) a été utilisé dans le processus de décontamination des chambres des patients atteints du COVID-19, des salles de traitement des patients et des postes de soins infirmiers. Cette étude démontre que l’utilisation du ClO₂, parallèlement à d’autres mesures, est efficace pour prévenir la propagation du SRAS-CoV-2 à partir des chambres de patients et des zones des services généraux contaminés.
Mécanisme d’inactivation virale par le ClO₂
Le ClO₂ réagit avec les composants viraux constitués de protéines (chaînes de résidus d’acides aminés) et de matériel génétique (acides nucléiques). Ces réactions affectent les virus, ce qui entraîne leur inactivation de plusieurs façons. La communauté scientifique poursuit ses recherches sur le mode d’action du ClO₂ sur les virus et sur la manière dont cette molécule active interagit spécifiquement avec les molécules virales.
Mode d’action sur les protéines virales
Contrairement à d’autres oxydants chimiques, le ClO₂ est très sélectif, réagissant extrêmement lentement (ou pas du tout) avec la plupart des composés organiques (par exemple les tissus vivants) qui sont connus pour inactiver d’autres oxydants chimiques tels que le chlore aqueux. Cependant, le ClO₂ réagit spécifiquement avec des acides aminés, à savoir la cystéine, la méthionine, la tyrosine et le tryptophane, et les modifie par oxydation (Noszticzius et al., 2013).
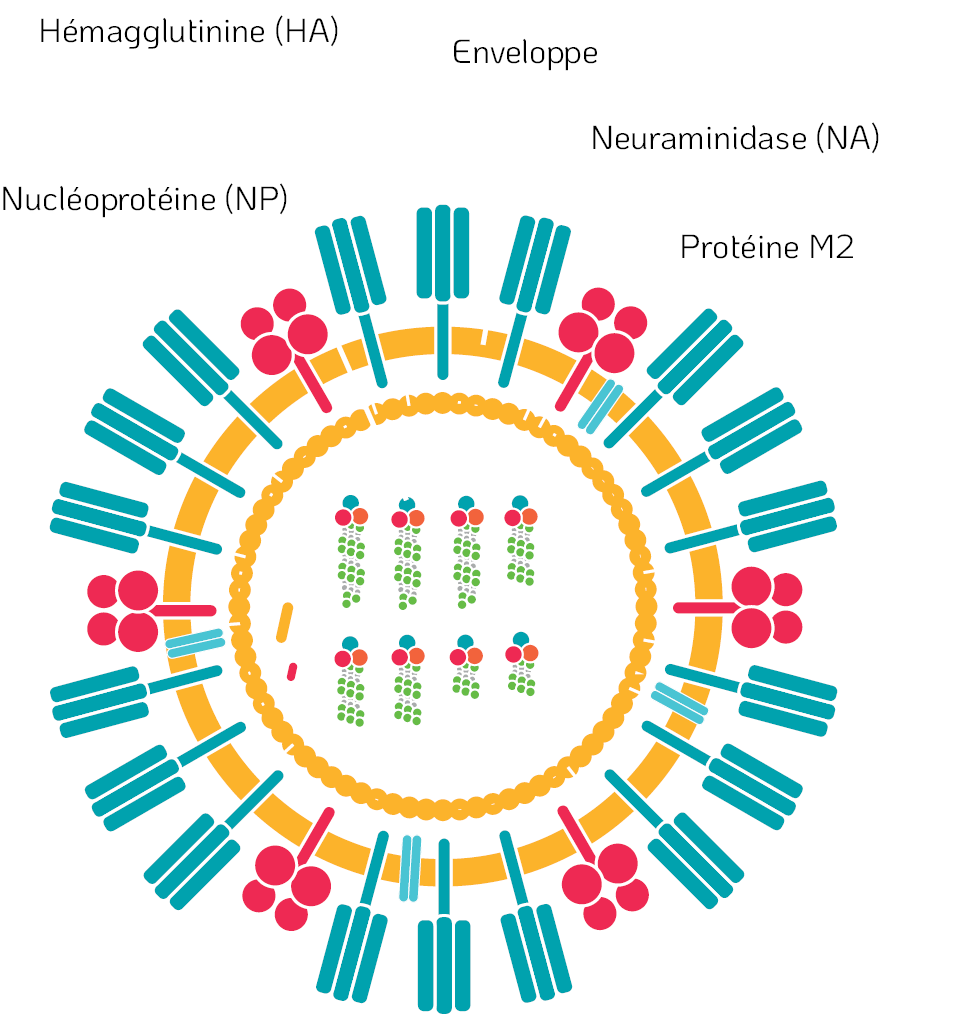
Ogata & Shibata (2008) ont démontré que le traitement par ClO₂ conduit à la dénaturation de l’hémagglutinine (HA) et de la neuraminidase (NA) présentes sur le virus de la grippe (Influenza A). Quatre peptides modèles (HA1, HA2, NA1 et NA2) ont été traités avec le ClO₂ et ont été analysés par HPLC en phase inverse. Le chromatogramme a indiqué plusieurs nouveaux pics peptidiques qui différaient complètement des pics peptidiques d’origine ; il en a été déduit que les peptides d’origine avaient été modifiés de manière covalente par réaction avec le ClO₂. La modification covalente des résidus d’acides aminés du tryptophane et de la tyrosine par le ClO₂ a été confirmée par spectroscopie de masse (MS). De telles modifications des résidus d’acides aminés ont semblé dénaturer les protéines HA et NA du virus de la grippe. Ces protéines sont essentielles pour le caractère infectieux du virus et leur dénaturation a par conséquent inactivé le virus.
Figure 4. Structure d’un virus enveloppé – Virus de la grippe.
On a constaté que d’autres peptides avaient également été modifiés au niveau de résidus de tryptophane et de tyrosine ; ceci a été suggéré sur d’autres protéines vitales telles que la Matrix-2(M2) dans l’enveloppe virale.
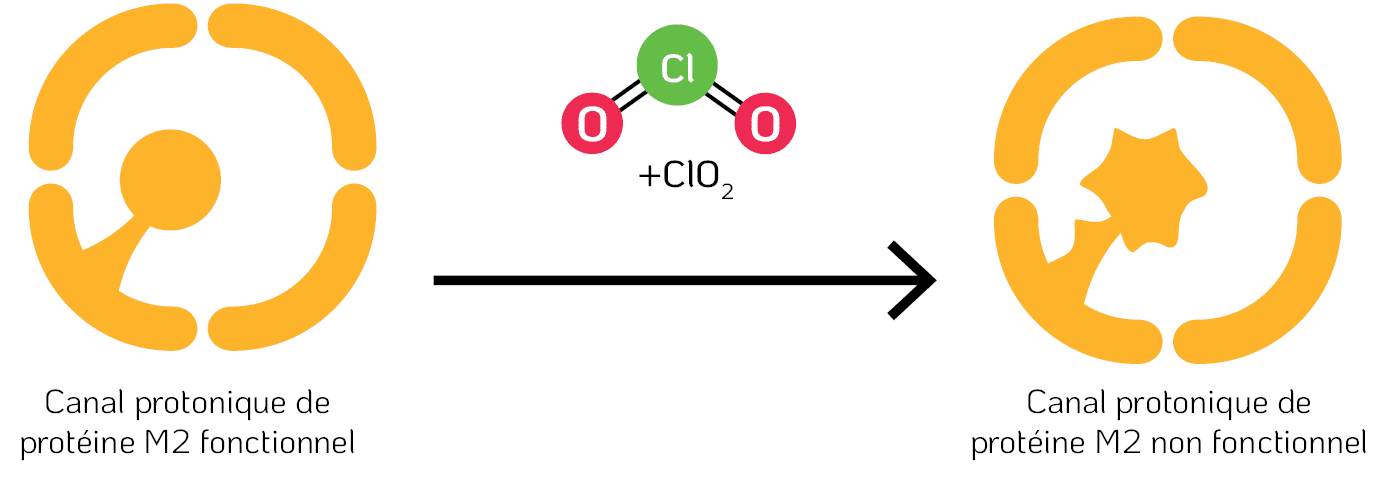
La protéine M2 de la grippe (Influenza A) forme un canal protonique qui régule le pH à travers la membrane virale lors de son entrée dans la cellule, déclenchant la libération du génome viral dans la cellule hôte, de manière à ce que la réplication virale puisse avoir lieu (Cady et al., 2009). Un résidu de tryptophane fait saillie dans le canal de la protéine M2 et agit comme un portail pour les protons. Comme le ClO₂ réagit avec le tryptophane dans divers peptides, il est probable que le résidu de tryptophane dans le canal de la protéine M2 a également été modifié par le ClO₂, entraînant l’arrêt de sa fonctionnalité clé (figure 5).
Figure 5. Dénaturation de la protéine Matrix-2 (M2) par le ClO₂. La protéine M2 est une viroporine (canal) sélective des protons dans l’enveloppe virale du virus de la grippe (Influenza A). Un résidu de tryptophane (Trp) agit comme un portail pour la médiation du transport des protons.
Mode d’action sur le génome viral
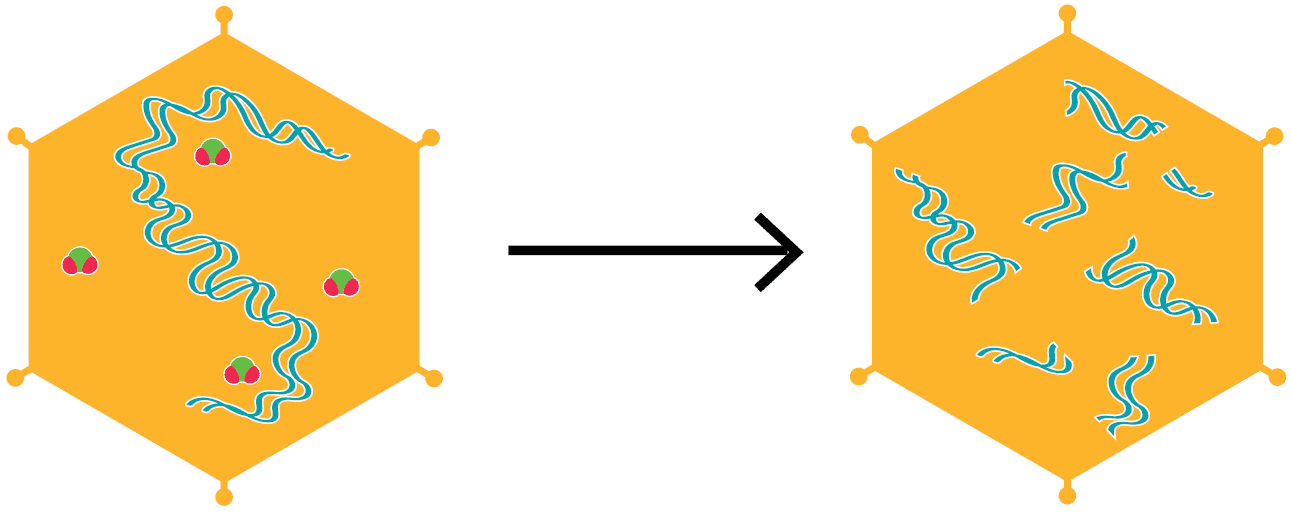
Une étude d’Alvarez et O’Brien (1982) a conclu que le ClO₂ inactive les virus de la polio (virus non enveloppés) en ciblant l’ARN viral, ce qui compromet la capacité du génome viral à servir de modèle pour la réplication virale. L’analyse de la sédimentation d’extraits de cellules HeLa infectées par des virus inactivés par le ClO₂ a montré une incorporation réduite de l’uridine (une des quatre unités de base qui composent l’ARN) dans le nouvel ARN viral. Dans cette étude, la cible critique du ClO₂ a été reconnue comme étant l’ARN viral, ce qui a entraîné l’incapacité du virus à se répliquer (figure 6).
Figure 6. Molécules de ClO₂ infiltrant un virus non enveloppé (à savoir le virus de la polio) et réagissant avec l’ARN (image adaptée d’après Thurman et Gerba, 1988).
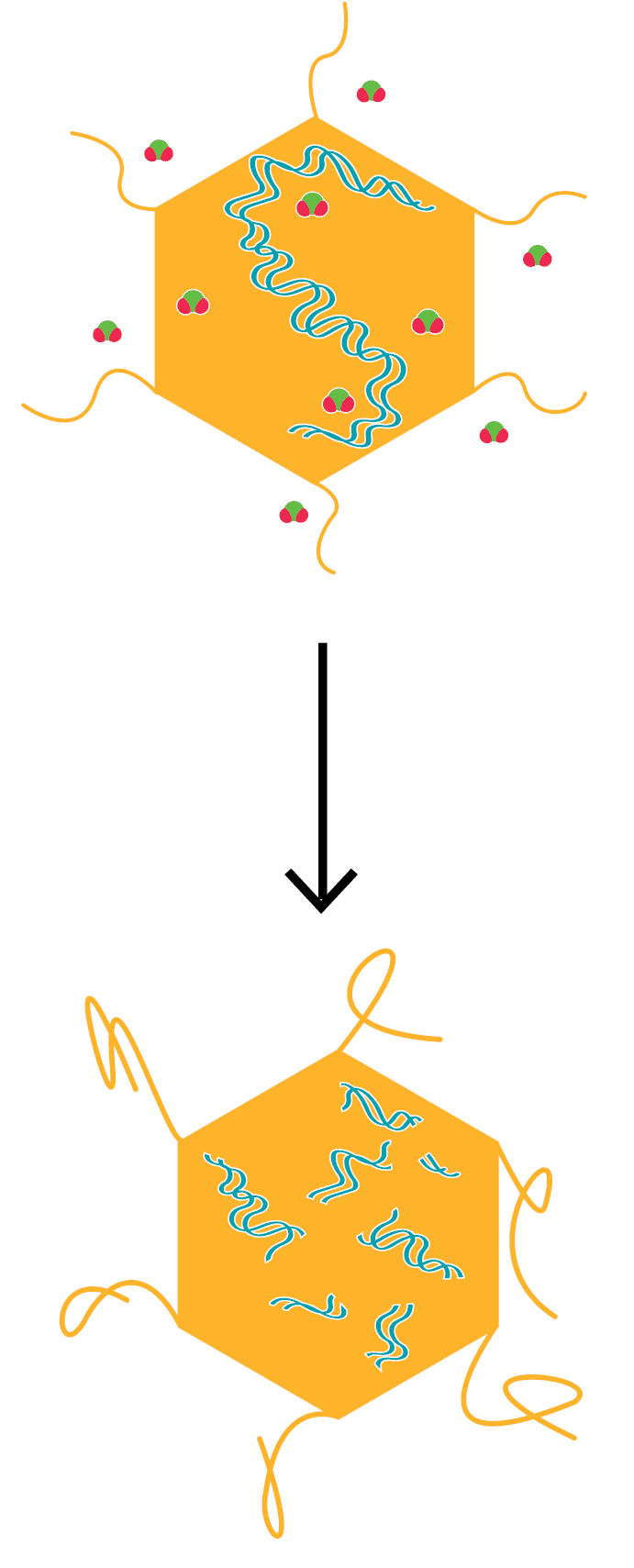
On a également observé que le ClO₂ inactive un autre virus non enveloppé, le virus de l’hépatite A (VHA), en détruisant simultanément l’antigénicité et en endommageant le génome viral. L’antigénicité est la capacité d’un antigène (situé sur la capside du VHA) à se lier spécifiquement à une protéine complémentaire, c’est-à-dire aux récepteurs des cellules hôtes.
Dans l’étude de Li et al. (2004), l’antigénicité a été mesurée par ELISA (enzymelinked immunosorbent assay), et le génome viral a été analysé par RT-PCR (reverse transcription polymerase chain reaction) à chevauchement long, montrant que la région 5’ non traduite a été endommagée par le ClO₂. L’étude a conclu que le ClO₂ réagissait à la fois avec l’ARN viral et avec la protéine de capside virale, empêchant le VHA de se fixer, de pénétrer et de se répliquer dans les cellules hôtes (figure 7).
Figure 7. Molécules de ClO₂ réagissant avec les antigènes HAV et l’ARN, entraînant des modifications qui nuisent à l’infectiosité (image adaptée d’après Thurman et Gerba, 1988).
Le virus de la polio et le VHA sont tous deux des virus non enveloppés, qui sont les plus résistants aux désinfectants. Le fait d’être efficace contre ces virus implique une efficacité contre d’autres virus de structure similaire et contre les virus enveloppés moins résistants.
Conclusion
L’activité virucide du ClO₂ a été bien établie par les études susmentionnées et par des tests d’efficacité virale conformes aux normes européennes et américaines. Ces connaissances ont donné les moyens à l’industrie de s’équiper de désinfectants taillés sur mesure pour la lutte contre les infections virales.
Le principe actif de nombreux produits Tristel consiste en une formulation brevetée de ClO₂. Ces produits font partie de la gamme Tristel pour la décontamination des instruments médicaux, et comprennent les lingettes Tristel Trio Wipes System et Tristel Duo ULT ou Duo OPH, ainsi que la gamme Cache, qui inclut des nettoyants et des désinfectants de surface respectueux de l’environnement, entre autres les produits JET et FUSE. Diverses études ont montré que le dioxyde de chlore réagit avec les virus en fonction de leur composition moléculaire et de leur structure. Au fur et à mesure que les recherches se poursuivent, ces nuances seront précisées.
References
Alvarez, M. E. and O’Brien, R. T. (1982) ‘Mechanisms of inactivation of poliovirus by chlorine dioxide and iodine’, Applied and Environmental Microbiology, 44(5), pp. 1064–1071. doi: 10.1128/aem.44.5.1064-1071.1982.
Cady, S. D. et al. (2009) ‘Structure and function of the influenza A M2 proton channel’, Biochemistry, 48(31), pp. 7356–7364. doi: 10.1021/bi9008837.
Centers for Disease Control and Prevention (2008) ‘Guideline for Disinfection and Sterilization in Healthcare Facilities, 2008; Miscellaneous Inactivating Agents’, CDC website, (May), pp. 9–13. doi: 1.
Fukayama, M. Y. et al. (1986) ‘Reactions of aqueous chlorine and chlorine dioxine with model food compounds’, Environmental Health Perspectives, Vol. 69, pp. 267–274. doi: 10.1289/ehp.8669267.
Jerry, J. et al. (2020) ‘Do established infection prevention and control measures prevent spread of SARS-CoV-2 to the hospital environment beyond the patient room?’, Journal of Hospital Infection. The Healthcare Infection Society. doi: 10.1016/j.jhin.2020.06.026.
Li, J. W. et al. (2004) ‘Mechanisms of inactivation of hepatitis a virus in water by chlorine dioxide’, Water Research, 38(6), pp. 1514–1519. doi: 10.1016/j.watres.2003.12.021.
Meyers, C., Milici, J. and Robison, R. (2020) ‘The ability of two chlorine dioxide chemistries to inactivate human papillomavirus-contaminated endocavitary ultrasound probes and nasendoscopes’, Journal of Medical Virology, (November 2019). doi: 10.1002/jmv.25666.
Miura, T. and Shibata, T. (2010) ‘Antiviral Effect of Chlorine Dioxide against Influenza Virus and Its Application for Infection Control’, The Open Antimicrobial Agents Journal, 2(2), pp. 71–78. doi: 10.2174/1876518101002020071.
Noszticzius, Z. et al. (2013) ‘Chlorine dioxide is a size-selective antimicrobial agent’, PLoS ONE, 8(11), pp. 1–10. doi: 10.1371/journal.pone.0079157.
Society, M. (2020) Viruses. Available at: https://microbiologysociety.org/why-microbiology-matters/what-is-microbiology/viruses.html (Accessed: 25 June 2020).
Thurman, R. B. and Gerba, C. P. (1988) ‘Molecular Mechanisms of Viral Inactivation by Water Disinfectants’, Advances in Applied Microbiology, 33(C), pp. 75–105. doi: 10.1016/S0065-2164(08)70205-3.
©2021 Tristel Solution Limited. All rights reserved.